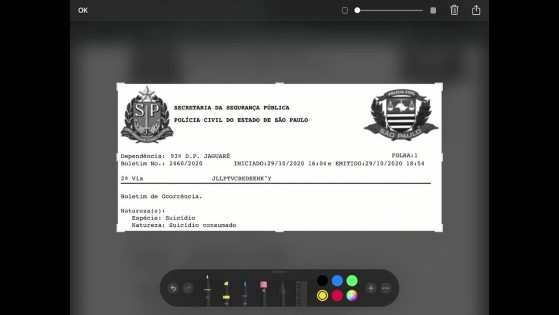
A causa da morte do voluntário da CoronaVac, que teria feito a Anvisa suspender os testes com a vacina, foi suicídio, de acordo com boletim de ocorrência obtido pela TV Globo nesta terça-feira (10.11).
De acordo com o boletim de ocorrência registrado às 16h02 de 29 de outubro em uma delegacia da Zona Oeste de São Paulo, policiais militares foram acionados pelo rádio para uma "ocorrência de encontro de cadáver". Ao chegarem ao apartamento, uma pessoa mostrou a vítima desmaiada no chão do banheiro com uma seringa perto do braço e diversas ampolas de remédio. O corpo do jovem de 32 anos foi para o Instituto Médico Legal (IML).
O laudo necroscópico deve ser divulgado depois porque, neste caso, o resultado depende do exame toxicológico, que demora mais tempo para ficar pronto.
Mais cedo, o governo de São Paulo afirmou, em coletiva de imprensa, ser impossível relacionar o "evento adverso grave" que acometeu o voluntário do estudo clínico da CoronaVac com o imunizante.
Na noite desta segunda-feira (9), a Anvisa suspendeu os testes da vacina da Sinovac, feita em parceria com o Instituto Butantan, após ter sido notificada sobre um "evento adverso grave" em um voluntário.
“Os dados são transparentes. Por que nós sabemos e temos certeza de que não é um evento relacionado à vacina? Como eu disse, do ponto de vista clínico do caso e nós não podemos dar detalhes, infelizmente, é impossível, é impossível que haja relacionamento desse evento com a vacina, impossível, eu acho que essa definição encerra um pouco essa discussão", afirmou o diretor do Instituto Butantan, Dimas Covas.
A declaração foi dada pelo diretor durante coletiva de imprensa na sede do Instituto Butantan, após o governo paulista se reunir virtualmente com representantes da Anvisa para tratar sobre a suspensão dos testes. Na noite de segunda, Dimas Covas afirmou que o voluntário morreu, mas disse que o óbito não tinha qualquer relação com a vacina (leia mais abaixo).
Durante a coletiva desta terça, representantes do governo de São Paulo demonstraram indignação com a medida e defenderam que não há relação entre o evento adverso e o imunizante.
"Não houve nenhuma relação da vacina com o evento adverso grave apresentado", defendeu o secretário estadual de saúde, Jean Gorinchteyn.
Dimas Covas disse que a suspensão, além de desnecessária, provoca "dor e sofrimento nos voluntários". “Não haveria a necessidade desse tipo de medida, que poderia ser resolvido administrativamente, como foi feito hoje de manhã”, disse Covas.
"Se interromper um estudo clínico que está indo muito bem causa sofrimento, causa dor, causa insegurança, naquelas pessoas que já foram submetidos ao estudo, causa dificuldade naqueles que querem ser submetidos ao estudo e que estão na fila para receber a vacina ou o placebo. Ou seja, são os voluntários, as pessoas que se dedicaram a esse estudo exatamente para trazer a esperança da vacina", disse Covas.
Anvisa foi notificada no início de novembro - Ainda de acordo com Dimas Covas, a Anvisa foi notificada do evento adverso no voluntário no dia 6 de novembro. "Nós estamos tratando aqui de um evento adverso grave que não tem relação com a vacina. Repito: um evento adverso grave que não tem relação com a vacina. Essa informação está disponível à Anvisa desde o dia 6, quando foi notificado o efeito adverso grave".
O diretor criticou o comportamento da Agência e a forma como o Instituto recebeu a notícia da interrupção dos testes.
"Dia 6 a Anvisa recebeu um documento dizendo: 'olha um participante do estudo clínico teve um evento adverso grave não relacionado com a vacina' ponto. O que que se espera diante de um comunicado desse? 'Olha, ok, vamos avaliar, vamos nos reunir, vamos ver quais foram as causas desse evento adverso, se você está dizendo que não tem relação com a vacina, vamos apurar'. É isso o que a gente espera. Foi isso o que aconteceu? Não. Quer dizer, esse encaminhamento foi feito dia 06, ontem dia 09, às 20h40, encaminham um e-mail ao Butantan dizendo que haveria uma reunião hoje para tratar do evento adverso grave, mas ao mesmo tempo anunciava a suspensão do estudo. Oito e quarenta da noite, 20h40 da noite, 20 minutos depois essa notícia estava em rede nacional, 20 minutos depois de nós termos sido notificado por e-mail, a notícia estava em rede nacional".
Dimas Covas disse ainda que o governo reenviou todos os esclarecimentos à Anvisa e aguarda que a liberação o mais rápido possível. "Ela agora está apta a tomar a decisão de retomar o estudo o mais rápido possível", afirmou o diretor.
A expectativa do diretor é a de que, após os esclarecimentos, a Anvisa retome os estudos ainda nesta semana, possivelmente nesta quarta-feira (11).
Óbito de voluntário - Na segunda-feira (09) o diretor do instituto Butantan deu uma em entrevista à TV cultura onde afirmou que o efeito adverso trata-se de um óbito, no entanto, no dia seguinte à entrevista, durante a coletiva, Dimas disse que não falou que se tratava de um óbito, ou não, e que não poderia dar detalhes do ocorrido.
“O efeito adverso grave, observado em um voluntário não tem relação com a vacina. Não podemos dar detalhes a vocês porque isso envolve sigilo. Tem aí todo um aspecto ético que nos impede de dar as características do voluntário, ou da voluntária. O que eu afirmo a vocês é que esses dados estão todos de mão da Anvisa, estão todos fornecidos a Anvisa”.
Dimas Covas disse ainda que a Anvisa tem todas as informações e que não poderia "burlar a ética" ou "trair a confiança" que a família do voluntário tem no instituto.
"Nesse momento cabe a Anvisa que tem todos os dados dar essas informações, nós não podemos aqui burlar a ética, trair a confiança que a família [do voluntário] tem em nós. Nós não podemos dar qual foi o motivo do evento, o que que levou aos eventos, porque essas informações podem ser muito dolorosas para família e nós temos que respeitar esse aspecto. O que nós dizemos e repito: o evento não tem relação com a vacina".
Interrupção - A Anvisa informou que foi notificada do "evento" em 29 de outubro. Mais de 10 dias depois, determinou que nenhum novo voluntário poderá ser vacinado até que a agência possa avaliar os dados e "julgar o risco/benefício da continuidade do estudo".
Segundo uma lista divulgada pela agência, são considerados eventos adversos graves "morte, evento adverso potencialmente fatal, incapacidade ou invalidez persistente, internação hospitalar do paciente, anomalia congênita ou defeito de nascimento, qualquer suspeita de transmissão de agente infeccioso por meio de um dispositivo médico e evento clinicamente significante".
Comunicado Sinovac - Nesta terça-feira (10), a Sinovac, farmacêutica chinesa responsável pelo desenvolvimento da CoronaVac, afirmou em comunicado que "está confiante na segurança da vacina" contra a Covid-19.
Segundo o jornalista José Roberto Burnier, da GloboNews, a morte do voluntário não foi causada por doença respiratória. O paciente, de 33 anos, também não tinha comorbidades.
A Sinovac afirmou que "ficamos sabendo que o chefe do Instituto Butantan acreditava que esse evento adverso grave não tem relação com a vacina".
A empresa afirmou que o estudo clínico em fase 3 no Brasil "é realizado estritamente de acordo com os requisitos do GCP" (Good Clinical Practice, ou "boas práticas clínicas" em tradução livre).
O presidente Jair Bolsonaro afirmou, em uma rede social, que o episódio é mais um em que "Jair Bolsonaro ganha”. No mesmo post ele citou o governador de São Paulo, João Doria (PSDB).
A CoronaVac é uma das candidatas a vacina contra o coronavírus e é desenvolvida pela Sinovac em parceria com o Butantan, em São Paulo. Com a interrupção do estudo, nenhum novo voluntário poderá ser vacinado.
Butantan estranha decisão
Na noite desta segunda, o diretor-geral do Instituto Butantan, Dimas Covas, disse que recebeu com estranhamento a notícia da suspensão temporária dos testes em humanos da CoronaVac no Brasil.
Segundo Covas, se trata de "um óbito não relacionado à vacina" e, portanto, "não existe nenhum momento [ou motivo] para interrupção do estudo clínico" da fase 3.
"Em primeiro, a Anvisa foi notificada de um óbito, não de um efeito adverso. Isso é diferente. Nós até estranhamos um pouco essa decisão da Anvisa, porque é um óbito não relacionado à vacina", afirmou o diretor do Butantan.
"Como são mais de 10 mil voluntários nesse momento, podem acontecer óbitos. Nesse momento, [o voluntário] pode ter um acidente de trânsito e morrer. Ou seja, é um óbito não relacionado à vacina. É o caso aqui. Ocorreu um óbito que não tem relação com a vacina", disse Dimas Covas na TV Cultura.
O diretor também afirmou que o Butantan já pediu esclarecimentos à Anvisa sobre a interrupção e que espera ter mais detalhes na manhã desta terça-feira (10).
Entre no grupo do VGNotícias no WhatsApp e receba notícias em tempo real (CLIQUE AQUI).